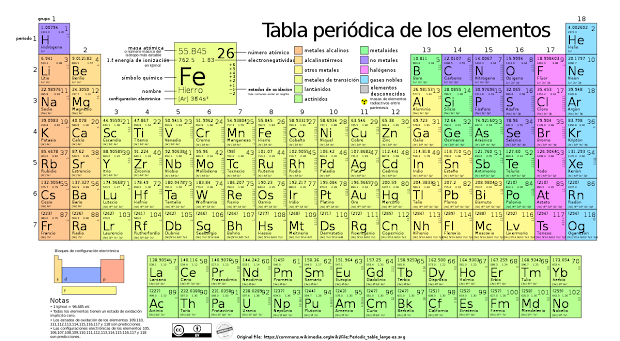
La Tabla periódica de los elementos es un gráfico (una tabla) en la que se encuentran dispuestos todos los elementos químicos conocidos por el hombre, ordenados según su número atómico (protones), configuración de electrones y propiedades químicas específicas.
Fuente: https://www.ejemplos.co/tabla-periodica-informacion-y-ejemplos/#ixzz6oyH8HqF3
Esta es otra forma de organizar a los elementos químicos, sin necesidad de removerlos, en base a algunas propiedades físicas y químicas de los mismos. El 78% de los elementos son considerados metales, 15% no-metales y 7% metaloides. En forma general, los elementos se clasifican en metales y no-metales.
Metales. Noventa y un elementos son considerados como metales, aun cuando dentro de ellos existen cuatro elementos líquidos; se localizan a la derecha de la tabla(a mano izquierda del lector), y algunas de sus características son las siguientes:
Características físicas:
- Por lo general son sólidos a temperatura ambiental, excepto Mercurio, Galio, Cesio y Francio que son líquidos.
- El color es parecido al de la plata, exceptuando el cobre (color rojo) y el oro (color amarillo).
- Poseen un brillo llamado brillo metálico, cuando se frotan (característica principal).
- Conducen muy bien las energías eléctrica y calorífica.
- Son dúctiles (forma hilos metálicos) y maleables (forman laminas).
- También son elásticos y tenaces (resistentes a la ruptura).
Propiedades químicas
- Los elementos metálicos presentan valores bajos en la mayoría de las propiedades periódicas, pues sus átomos al poseer muy pocos electrones en la última capa casi no pueden retenerlos, por lo que finalizan perdiéndolos cuando se unen a átomos no-metales, convirtiéndose en cationes.
- Por la condición anterior, son muy reactivos, es decir, buscan unirse con los demás elementos no-metales, principalmente con el oxígeno, con el cual forman óxidos, llamados óxidos básicos.
- Cuando estos óxidos básicos se combinan con el agua forman los hidróxidos.
- Los elementos van perdiendo su condición de metales a medida que se avanza de izquierda a derecha en los periodos, pero se aumenta cuando se avanza de arriba hacia abajo en los grupos; por lo tanto, el Bario, el Radio, el Cerio y el Torio son los elementos más metálicos en la tabla periódica. Los elementos de las hileras 6 y 7 que están fuera de la tabla también se consideran metales.
No- Metales. Diecinueve elementos son considerados no-metales, habiendo entre ellos 5 sólidos, uno liquido(Bromo) y 13 gases; en la tabla están localizados a mano derecha del lector, estando separados de los metales por una línea diagonal, en forma de grada, la que comienza en el Boro y finaliza en el Oberón.
Las características de estos elementos son contrarias a la de los metales, entre las cuales están:
Características físicas:
- No poseen brillo, con excepción del Selenio y Yodo.
- Son pésimos conductores del calor y la electricidad, con excepción del Carbono.
- Los elementos no-metales sólidos son quebradizos, por lo cual no son dúctiles ni maleables.
Características químicas:
- En este punto, los no-metales se dividen en: gases nobles y resto de elementos no metales; se creía en el siglo pasado que los gases nobles no reaccionaban, es decir, no formaban enlaces químicos, criterio que ha sido desvanecido hoy en día, pues el Xenón si forma parte de verdaderas reacciones químicas. Igual se piensa que sea para el resto de gases nobles.
UBICACION DE LOS METALES, NO-METALES Y METALOIDES
EN LA TABLA PERIODICA

El resto de elementos no-metales presentan las características químicas siguientes:
- Los átomos presentan de 3 a 7 electrones en el nivel de energía llamado nivel de valencia.
- Por lo anterior, estos átomos tienden a ganar electrones, formando así aniones.
- Cuando se unen al Oxigeno forman óxidos ácidos, que por lo general son gases.
- Cuando a estos óxidos ácidos se les agrega agua entonces forman los oxácidos.
Metaloides. Estos elementos tienen algunas características de los metales y otras de los no-metales, es decir, tienen características de los dos grupos. También se les conoce como semi-metales; se localizan a ambos lados de la línea diagonal y son un total de ocho.
Características generales.
- La mayoría tienen brillo metálico.
- Son sólidos a temperatura ambiente.
- Son semiconductores de la electricidad y el calor.
- Son quebradizos, por lo que no son dúctiles ni maleables.
- Pueden formar hidróxidos y ácidos.
- Reaccionan muy bien con el oxígeno y los elementos del grupo VII A (halógenos).
Lea atentamente el siguiente texto y subraye las ideas principales, acerca de qué son y cómo están
organizados los grupos de elementos, en la Tabla Periódica.
4. Grupos y periodos de la Tabla Periódica
Grupos o familias: La Tabla Periódica moderna presenta un ordenamiento de los 118 elementos que se conocen actualmente según su número atómico (Z).
Los elementos se disponen en filas horizontales, llamadas periodos, y en columnas denominadas grupos o familias.
Los grupos son las columnas de la Tabla Periódica y se designan con los números romanos del I a VIII. Se encuentran divididos en los subgrupos A y B. El número romano representa la valencia del grupo. Los grupos indican el número de electrones que tienen los elementos en su capa más externa o nivel de valencia, por lo que presentan propiedades químicas similares.
Veamos:
PERIODOS:
- Los periodos corresponden a un ordenamiento horizontal, es decir, a las filas de la tabla periódica.
- Los elementos de cada período tienen diferentes propiedades, pero poseen la misma cantidad de niveles en su estructura atómica.
- En total la tabla periódica tiene 7 períodos.
4.1 Grupos o familias de la Tabla Periodica:
- Grupo I A: Metales alcalinos:
- Grupo II A: Metales Alcalinotérreos:
- Grupo III A: Elementos térreos o familia del boro.
El boro (B) es el único metaloide de éste grupo; es duro y frágil. Los otros elementos, incluyendo el aluminio (Al), son metales, buenos conductores de la electricidad y el calor, presentan apariencia plateada y son bastante blandos. Los compuestos del boro (B) son empleados en la fabricación de vidrios refractarios, es decir, resistentes al calor y, los compuestos de aluminio (Al) son empleados en la fabricación de envases, utensilios de cocina, medicamentos y productos para el aseo personal.
- Grupo IV A: Elementos de la familia del carbono:
En éste grupo se encuentran elementos que presentan diversidad en sus propiedades. Por ejemplo, el carbono (C) es un no metal; el silicio (Si) aunque es no metal, presenta propiedades eléctricas de semiconductor; el germanio (Ge) es un metaloide y el estaño (Sn) y plomo (Pb) tienen carácter metálico. Las aplicaciones de éste grupo incluyen: el germanio se utiliza en la fabricación de aparatos eléctricos como televisores y juegos de computadores; el estaño, al igual que el aluminio, presenta resistencia a la oxidación; es el componente principal de las aleaciones del bronce y de las soldaduras; el plomo se utiliza como aditivo en la gasolina y también en la fabricación de trajes de protección contra las radiaciones.
- Grupo V A: Elementos de la familia del nitrógeno.
Todos los elementos de éste grupo con excepción del nitrógeno (N), son sólidos a temperatura ambiente. Las aplicaciones de éste grupo incluyen: el fósforo (P) que se encuentra como fósforo blanco que reacciona con el oxígeno del aire, y como fósforo rojo, utilizado en la fabricación de cerillas; el arsénico (As) es un semimetal y se utiliza en la fabricación de insecticidas; el antimonio (Sb) es un elemento tóxico y se emplea en aleaciones y dispositivos semiconductores; el bismuto (Bi), frágil y de color rosado, se utiliza en aleaciones y sus compuestos se utilizan en la fabricación de cosméticos y medicamentos.
- Grupo VI A: Elementos de la familia del oxígeno.

- Grupo VII A: Elementos de la familia de los halógenos.
 Los halógenos reaccionan fácilmente
con los metales formando sales. El cloro, el flúor y el yodo son elementos
esenciales a nivel biológico; por ejemplo, el yodo (I) contribuye con el buen
funcionamiento de la tiroides; el cloro (Cl) forma parte de los ácidos
gástricos y el flúor (F) interviene en la formación del esmalte dental. El
bromo (Br) se emplea en el recubrimiento de películas fotográficas.
Los halógenos reaccionan fácilmente
con los metales formando sales. El cloro, el flúor y el yodo son elementos
esenciales a nivel biológico; por ejemplo, el yodo (I) contribuye con el buen
funcionamiento de la tiroides; el cloro (Cl) forma parte de los ácidos
gástricos y el flúor (F) interviene en la formación del esmalte dental. El
bromo (Br) se emplea en el recubrimiento de películas fotográficas.
- Grupo VIII A: Elementos gases nobles o inertes
- Grupo B:
Elementos de transición Estos elementos se ubican en la parte central de la
Tabla Periódica entre los grupos II A y III A. Todos son metales a excepción
del mercurio (Hg). Se emplean en la fabricación de armas y herramientas, y en
la elaboración de finos y delicados adornos. También son parte importante en la
construcción, pues con metales como el hierro (Fe) se diseñan estructuras para
construir casas, grandes edificaciones y puentes entre otros.
Tomado y adaptado
de: Mondragón, C., Peña, L., Sánchez, M., Arbeláez, F., & González, D
4.2 Periodos de la Tabla Periódica:
Periodos: Los periodos se designan con números arábigos del 1 al 7 y corresponden a las filas horizontales de la
Tabla Periódica.
Cada periodo indica la iniciación de un nuevo nivel de energía. La Tabla Periódica moderna consta de
siete periodos.
- Periodo 1 Este comprende sólo dos elementos: hidrógeno (H) y helio (He). Estos son los dos elementos gaseosos más ligeros que se encuentran en la naturaleza.
- Periodo 2 En este se ubican el oxígeno (O) y el nitrógeno (N), gases fundamentales en la composición del aire que respiramos, así como el carbono (C), elemento fundamental de los seres vivos. Comienza con metales brillantes y reactivos a la izquierda y se concluye con un gas noble incoloro y no reactivo a la derecha.
- Periodo 3 En este periodo aparecen el fósforo (P) y el azufre (S), elementos importantes para la síntesis de las proteínas.
- Periodo 4 En este periodo se encuentran metales como titanio (Ti), cromo (Cr), hierro (Fe), cobalto (Co), níquel (Ni), cobre (Cu) y zinc (Zn), ampliamente utilizados en la industria.
- Periodo 5 En esta serie de destaca el yodo (I) por su valor biológico, tal y como se describió en el grupo de los halógenos.
- Periodo 6 En este se destacan el oro (Au) y el platino (Pt) como metales preciosos y el mercurio (Hg), que es el único metal líquido que existe en la naturaleza tal como lo indicamos en el grupo de los metales de transición.
- Periodo 7 Estos elementos presentan características parecidas entre sí. Los de mayor número atómico no se encuentran en la naturaleza y tienen tiempos de vida media cortos; todos son radiactivos.
5. Regiones de la tabla periódica: (s p d y f)
Para realizar la división de la tabla de los elementos en bloque, se tiene en cuenta el orbital en el que reside el último electrón.
- Bloque s: El bloque s corresponde a los dos primeros grupos, es decir, los alcalinos y los alcalinotérreos, sin olvidarnos del helio e hidrógeno.
- Bloque p: Corresponde a los seis últimos grupos. Contiene a todos los metaloides.
- Bloque d: Los grupos del 3 al 12 estarían en este bloque. Se puede decir que los metales de transición están en él.
- Bloque f: Se compone de los lantánidos y actínidos.
DESARROLLE EL SIGUIENTE CUESTIONARIO
PRIMERA PARTE:
- Tenga en cuenta los conceptos sobre la organización de la Tabla Periódica y los aportes de clase, por parte del docente.
3). Teniendo en cuenta la lectura del taller, desarrolle la siguiente tabla:
A). Complete la tabla, teniendo en cuenta la siguiente información:
- En la columna "Grupo o familia de elementos" indique el símbolo y el grupo o familia al cual pertenecen los siguientes elementos: Cloro - Yodo - Fosforo - Carbono - Azufre - Radio - Potasio.
- En la columna de "propiedades", describa las propiedades físicas y químicas para cada elemento químico.
- En la columna de "aplicación", describa el uso de cada uno de estos elementos químicos, en la industria farmacéutica , industrial, ambiental o alimenticia:

c | y | o | |||||||||||||||
z | |||||||||||||||||
s | |||||||||||||||||
x | f | t | |||||||||||||||
N | |||||||||||||||||
- Periodo , grupo, región, (s, p, d y f)
- carácter (metálico, no metálico)
- Dos propiedades físicas de cada elemento del diagrama.
- Indica los elementos ubicados en el mismo grupo y los ubicados en el mismo período.
- Niveles de energía que presenta el átomo de cada elemento.
- Escribe 2 diferencias entre elemento y compuesto y 2 ejemplos de cada uno.
- Escribe El elemento mas electronegativo.
- Para las letras C-T-Y-O indica:
- Numero atómico
- Distribución electrónica
- Período
- Carácter
- Usos
- Grupo
- Región















Comentarios
Publicar un comentario