FUNCIÓN INORGÁNICA SALES
FORMACION DE SALES.
Las sales son cristales y solubles en agua, por lo general. Son sustancias binarias, ternarias y cuaternarias. Existen 2 tipos principales de ellas:
- a. Sales haloideas.
- b. Sales oxisales. Estas se clasifican en 4 tipos: sales neutras, ácidas, básicas y sales dobles.
Las diferentes sales resultan de la reacción entre un ácido y una base, siendo esta reacción de neutralización completa o bien parcial, y en todos los casos se produce también agua
Sales haloides. Llamadas también sales haloideas y no-oxigenadas. Este tipo de sustancias se forman por una reacción de neutralización entre un hidrácido y un hidróxido o base, sobrando agua. Son compuestos binarios pues la sal contiene un metal y un no-metal halógeno .
1 .HCl + NaOH → NaCl + H2 O3
Neutralización entre Ácido Clorhídrico (Ácido) e Hidróxido de Sodio (Base),
para producir la sal Cloruro de Sodio más Agua.
1 .HCl + NaOH → NaCl + H2 O3
Neutralización entre Ácido Clorhídrico (Ácido) e Hidróxido de Sodio (Base),
para producir la sal Cloruro de Sodio más Agua.
2 Zn + 2HCl → ZnCl2+H2
Reacción de Zinc elemental con Ácido Clorhídrico, para producir la sal Cloruro de Zinc, más Hidrógeno en su forma gaseosa.
Para nombrar la sal haloidea se pone primero el nombre del no-metal, con terminación uro, y se le agrega el nombre del elemento metal. En este caso la sal recibe el nombre(nomenclatura)
de fluoruro de litio. Los dos hidrógenos del agua provienen uno del hidrácido y el otro del hidróxido, y el oxígeno proviene del hidróxido; por lo tanto, solo sobran el flúor (F) y el litio (Li), los cuales se unen y forman la sal haloidea (LiF). Otros ejemplos balanceados son:
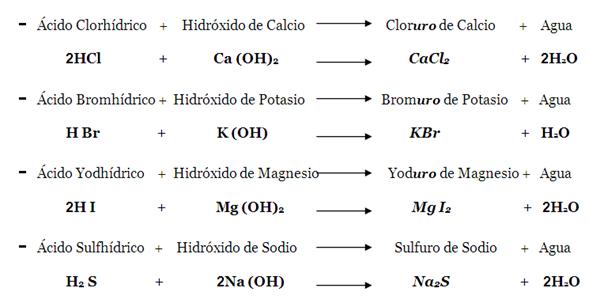
1.Nomenclatura de las Sales Binarias:
- Nomenclatura Tradicional: no metal + sufijo "-uro" + metal + sufijo de valencia del metal (oso para la menor e ico para la mayor)
- NaCl: Cloruro sódico (solo posee 1 valencia → "-ico")
- FeCl2: Cloruro ferroso
- FeCl3: Cloruro férrico
- PbS: Sulfuro plumboso
- PbS2: Sulfuro plúmbico
- CoS: Sulfuro cobaltoso
- Co2S3: Sulfuro cobáltico
- 2
EJERCICIOS
| |
| Formular los siguientes compuestos: | Nombrar los siguientes compuestos: |
| a) Dicloruro de zinc | a) NaBr |
| b) Seleniuro sódico | b) BaF2 |
| c) Sulfuro ferroso | c) NiCl2 |
| d) Ioduro de calcio | d) CuCl2 |
| e) Difluoruro de magnesio | e) SrS |
NOMENCLATURA STOCK
3. ESCRIBA LAS FORMULAS MOLECULARES
Cloruro de cobre(II)
Bromuro de sodio
Fluoruro de calcio
Cloruro de plomo(II)
Yoduro de platino(IV)
Sulfuro de hierro(III)
Telururo de níquel(III)
Seleniuro de berilio
Bromuro de mercurio(II)
Sulfuro de amonio
Seleniuro de plomo(IV)
4. Realiza los ejercicios de la siguiente pagina : 100 puntos educaplay
https://es.educaplay.com/es/recursoseducativos/894151/sales_haloideas.htm
5. Construye las reacciones químicas para los primeros 7 ejemplos del cuadro numero 1
Oxisales. Estas sales se conocen también como reacciones de neutralización. Cuando se combina un oxácido con un hidróxido se obtienen o producen la oxisal y un poco de agua. Anteriormente se apuntó que existen cuatro tipos de oxisales, las que se explican a continuación.
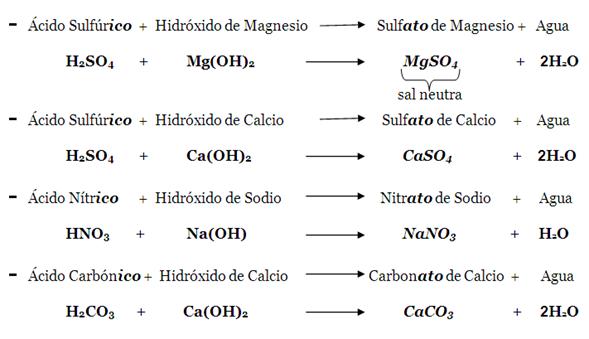
a. Sal neutra. Formada por un metal (del hidróxido), un no-metal y oxigeno (del oxácido);
los metales del hidróxido sustituyen totalmente a los hidrógenos del oxácido.

Recuerde que un oxácido se obtiene por combinar un oxido acido con agua; el hidróxido resulta de combinar un oxido básico con agua, y al combinar el oxácido con el hidróxido luego se producen la sal neutra y el agua. La ecuación general anterior se puede desglosar así:

Observe que la sal neutra está formada solo por un metal (del hidróxido), un no-metal y Oxigeno (del oxácido), sobrando siempre agua. Nunca contiene Hidrogeno, porqué este se encuentra formando parte del agua. Respecto al nombre de estas sales, cuando el ácido termina en ico entonces la sal termina en ato, y cuando el ácido termina en oso entonces la sal termina en ito.
Ejemplos:
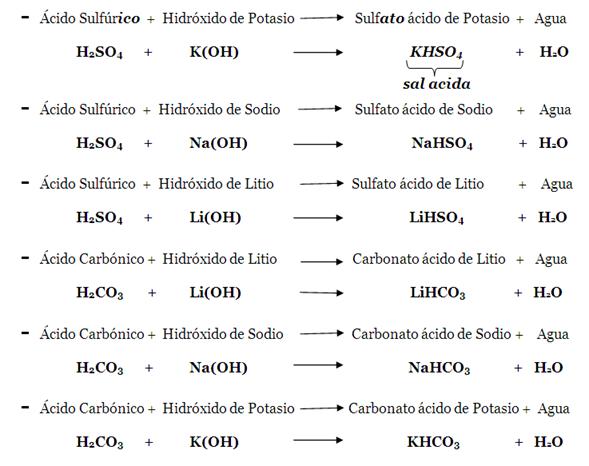
b. Sal ácida. Esta resulta de combinar un oxácido con un hidróxido, y está formada por un metal (del hidróxido), un hidrogeno, un no-metal y oxigeno (del oxácido), en ese orden.
Estas sales se diferencian de las anteriores en que llevan además hidrogeno, el que les da el carácter de acidas; los metales del Hidróxido sustituyen parcialmente a los Hidrógenos del oxácido. El ácido debe tener más de 1 hidrogeno (H2SO4, H2CO3) y el metal ser monovalente
Se nombran como las anteriores sales, agregando la palabra ácido entre la sal y el metal.

Ejemplos:
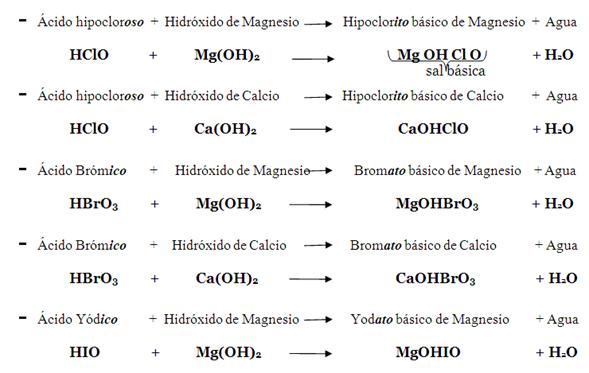
c. Sal básica. Resulta también de la combinación de un hidróxido con un oxácido, y está formada por un metal y un ion oxidrilo (OH), que provienen del hidróxido, y por un no-metal y oxígeno, que provienen del oxácido, en ese orden.

El metal junto con uno de los iones oxidrilos, que provienen del Hidróxido, se unen al no-metal y el oxígeno, que provienen del Oxácido, para formar la sal básica; así mismo, el otro ion oxidrilo (OH) se une al Hidrogeno del Oxácido para formar agua. Esto implica que el Hidróxido debe de tener dos iones oxidrilos (OH)2, por lo que el metal deberá ser bivalente (actuar con valencia 2). Recuerde que cuando el ácido termina en ico entonces la sal termina en ato, y cuando el ácido termina en oso entonces la sal termina en ito.
Ejemplos:
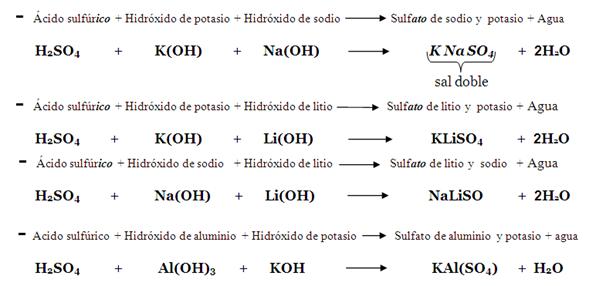
- c. Sal doble. Recuerde que la sal acida contiene un hidrogeno; sin embargo, en la sal doble este hidrogeno es sustituido por otro metal (catión) proveniente de un segundo Hidróxido. Esto significa que para formar una sal doble es necesario combinar 2 diferentes hidróxidos con un solo oxácido; así pues, este tipo de sal está formada por dos metales diferentes, un no-metal y el oxígeno (no siempre), en ese orden, sobrando siempre agua; esta última se forma a partir de la unión de los 2 iones oxidrilos (OH), que provienen de los Hidróxidos, más los hidrógenos del oxácido.
Ejemplos:

VÍDEOS INFORMATIVOS


gracias
ResponderEliminar